Gashydrate sind feste Einschlussverbindungen aus der Gruppe der Clathrate (lat. clatri = Verschluss, Gitter), bei denen eine Wirtskomponente - im Fall der Gashydrate Wasser - beim Vorhandensein einer oder mehrerer zusätzlicher stabilisierender Gastkomponenten, dreidimensionale, kristalline, eisähnliche Festkörperstrukturen ausbilden kann. Diese zeichnen sich insbesondere dadurch aus, dass es zu keiner chemischen Bindung zwischen den Wirts- und den Gastmolekülen kommt, sondern eine Stabilisierung lediglich durch Van-der-Waals Kräfte und Wasserstoffbrückenbindung geschieht.
In Abbildung 1 ist beispielhaft der Aufbau der beiden einfachsten elementaren Käfigtypen dargestellt, wie sie unter anderem von Wasser und Methan gebildet wird. Die Art der gebildeten Käfigstruktur hängt dabei vom Platzbedarf des Gastmoleküls und der Zusammensetzung der Gasphase ab. Praktisch gesehen bildet sich jeweils eine von drei möglichen Grundstrukturen, sI oder sII (beide kubisch) oder sH (hexagonal), die sich hauptsächlich durch das Anzahlverhältnis von größeren zu kleineren Hohlräumen unterscheiden. Da es zur Stabilisierung nicht notwendig ist, jeden zur Verfügung stehenden Käfig mit einem Gastmolekül zu besetzen, spricht man auch von nicht-stöchiometrischen Verbindungen bei denen sich das Besetzungsverhältnis mit Druck und Temperatur ändert.
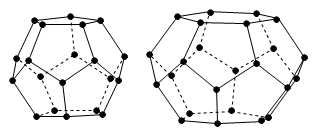
Abbildung 1: Elementare Käfigtypen von Struktur I (sI) Gashydraten
Der Stabilitätsbereich von Gashydraten liegt, je nach Art der Gastkomponente, bei Temperaturen bis zu 25°C und erhöhten Drücken. Abbildung 2 zeigt hierzu ein vereinfachtes Phasendiagramm von Wasser mit den Hydratbildnern Methan, Ethan, Propan und i-Butan.
Beim Überschreiten der Grenzstabilitätslinie kommt es, nach einer vom Sättigungsgrad und der Vorgeschichte abhängigen Induktionszeit, zum spontanen Phasenübergang und der damit verbundenen Bildung von Hydratkristallen. Die praktische Bedeutung von Gashydraten ergibt sich daraus, dass die oben genannten Gase den Hauptbestandteil der meisten Erdgase darstellen.
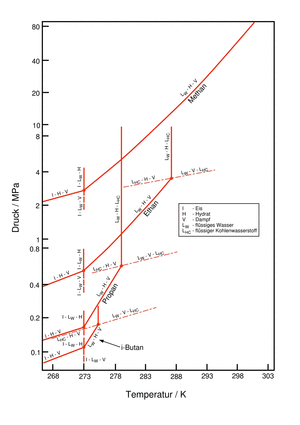
Abbildung 2: Phasendiagramm von Hydraten einfacher Kohlenwasserstoffe (nach Sloan 1998)


